Grafit ve Elmas: Aynı Element, Farklı İletkenlik
İstanbul, Türkiye – Periyodik tablonun en bilinen elementlerinden biri olan karbon, doğada çok farklı yüzlerle karşımıza çıkar. Bu yüzlerin en ünlüleri, bir kalemin ucundaki yumuşak ve opak grafitle, bir mücevheri süsleyen sert ve şeffaf elmastır. Her ikisi de saf karbondan oluşmasına rağmen, birinin elektriği iletip diğerinin yalıtkan olması, bilimin en büyüleyici paradokslarından biridir. Peki, bu iki kardeş malzeme arasındaki devasa farkın sırrı nedir? Cevap, atomların diziliş şeklinde, yani kristal yapılarında saklıdır.
Her Şey Atomik Bağlarda Başlar: sp² ve sp³ Hibritleşmesi
Bir karbon atomunun en dış yörüngesinde dört adet elektron bulunur ve bu elektronları diğer atomlarla bağ kurmak için kullanır. Grafit ve elmas arasındaki temel fark, karbon atomlarının bu dört elektronu nasıl paylaştığıdır.
Elmas: Mükemmel ve Rijit Yapı (sp³ Hibritleşmesi)
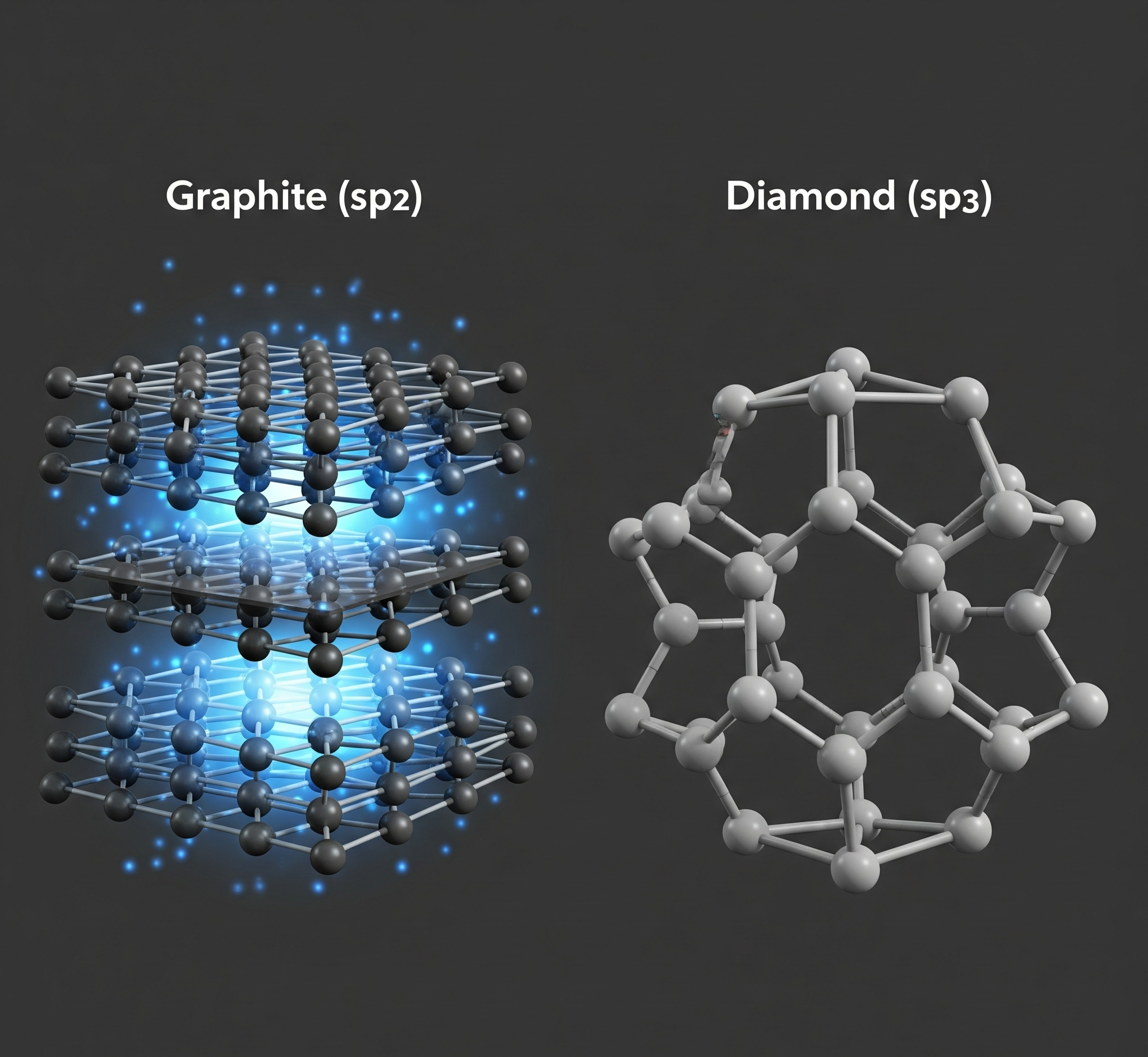
Elmas kristalinde her bir karbon atomu, kendisini çevreleyen diğer dört karbon atomuna kovalent bağ adı verilen güçlü kimyasal bağlarla bağlanır. Bu bağlanma şeklinde, atomun dört dış elektronunun tamamı kullanılır ve ortaya üç boyutlu, tetrahedral (düzgün dörtyüzlü) bir yapı çıkar. Bu yapı son derece rijit ve sağlamdır.
Elektriksel Yalıtkanlık: Elmasın yalıtkan olmasının sebebi tam olarak budur. Tüm elektronlar, bu güçlü kovalent bağlarda “kilitli” durumdadır ve kristal yapı içinde serbestçe hareket edemezler. Elektrik akımı, serbest elektronların hareketiyle oluştuğundan, elmasta hareket edecek serbest elektron bulunmaz. Bu yüzden elmas, mükemmel bir elektrik yalıtkanıdır.
Grafit: Katmanlı ve Kaygan Yapı (sp² Hibritleşmesi)
Grafitte ise her bir karbon atomu, aynı düzlemde bulunan diğer üç karbon atomuna güçlü kovalent bağlarla bağlanır. Bu bağlanmada, karbon atomu dört dış elektronundan sadece üçünü kullanır. Bu durum, hegzagonal (altıgen) halkalardan oluşan ve “grafen” adı verilen iki boyutlu tabakaların oluşmasını sağlar.
Elektriksel İletkenlik: İşte sihir burada gerçekleşir. Her karbon atomunun kullanmadığı o dördüncü elektron, ait olduğu atoma zayıf bir şekilde bağlı kalır ve bu grafen katmanları arasında serbestçe hareket edebilir. Bu “delokalize” olmuş veya “gezgin” elektronlar, bir bulut gibi katmanların arasında dolaşır. Grafite bir elektrik potansiyeli uygulandığında, bu serbest elektronlar kolayca hareket ederek elektrik akımını oluşturur. Bu nedenle grafit, metaller gibi davranarak iyi bir elektrik iletkeni olur.
Bu katmanlı yapı aynı zamanda grafitin neden bu kadar yumuşak ve kaygan olduğunu da açıklar. Güçlü bağlarla bağlı olan katmanlar, kendi aralarında Van der Waals adı verilen çok zayıf kuvvetlerle bir arada durur. Bu zayıf bağlar, katmanların birbiri üzerinden kolayca kaymasına olanak tanır – tıpkı bir kağıda yazı yazdığınızda kalem ucundan dökülen grafit katmanları gibi.
Termal İletkenlik: Roller Değişiyor
Elektriksel iletkenlikte durum grafitten yana olsa da, ısı (termal) iletkenliğinde roller tamamen değişir.
- Elmas: Mükemmel bir ısı iletkenidir. Rijit ve düzenli kristal yapısı, ısı enerjisinin (atomik titreşimler veya fononlar) yapı içinde minimum engelle ve çok hızlı bir şekilde yayılmasına izin verir. Bu özelliği sayesinde elmas, elektronik bileşenleri soğutmak için potansiyel bir malzeme olarak görülür.
- Grafit: Isıyı iletebilir, ancak genellikle elmas kadar verimli değildir. Isı iletkenliği de tıpkı elektrik iletkenliği gibi anizotropiktir; yani katmanlar boyunca ısıyı iyi iletirken, katmanlar arasında daha az iletir.
Sonuç olarak, grafit ve elmasın hikayesi, kimyada “yapı-özellik ilişkisinin” mükemmel bir örneğidir. Aynı temel yapı taşına (karbon atomu) sahip olmalarına rağmen, bu atomların üç boyutlu uzayda nasıl bir araya geldiği, onların fiziksel ve kimyasal karakterlerini tamamen değiştirir. Biri değerli bir yalıtkan, diğeri ise endüstriyel bir iletken olarak hayatımızın farklı alanlarında vazgeçilmez roller üstlenir.
Yorum yapabilmek için giriş yapmalısınız.


Yazar hakkında