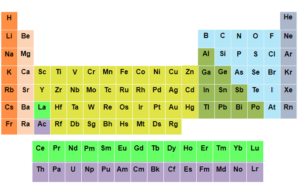
Periyodik çetvel, kimya dünyasının en önemli araçlarından biridir. Elementlerin bir düzen içinde sıralandığı bu tablo, sadece bilim insanlarının değil, lise ve ortaokul öğrencilerinin de kimyayı anlamalarına büyük bir yardımcıdır. Peki, periyodik çetvel nedir ve neden bu kadar önemlidir? Hadi birlikte keşfedelim!
Periyodik Çetvel Nedir?
Periyodik çetvel, dünyada bilinen tüm kimyasal elementlerin düzenli bir şekilde sıralandığı bir tablodur. Bu tabloyu oluştururken elementlerin atom numaralarına (proton sayısı) ve kimyasal özelliklerine göre bir düzen izlenmiştir.
Her kutucukta bir elementin şu bilgileri bulunur:
- Sembolü: Elementin kısa gösterimi (örneğin, H = Hidrojen, O = Oksijen)
- Atom Numarası: Elementin çekirdeğindeki proton sayısı.
- Atom Kütlesi: Elementin ortalama atom ağırlığı.
- Adı: Elementin tam adı.
Nasıl Okunur?
- Gruplar ve Periyotlar:
- Çetvel, dikey sütunlara (gruplar) ve yatay sıralara (periyotlar) ayrılmıştır.
- Gruplar, elementlerin kimyasal olarak benzer özellikler taşıdığı sütunlardır.
- Periyotlar ise elementlerin enerji seviyelerini temsil eder.
- Metaller, Ametal ve Yarı Metaller:
- Periyodik çetvelde solda metaller, sağda ametaller, arada ise yarı metaller bulunur.
- Metaller, genellikle parlak ve iletken maddelerdir. Örneğin, demir (Fe) ve bakır (Cu).
- Ametaller, elektriği iletmez ve genelde kırılgandır. Örneğin, karbon (C) ve oksijen (O).
- Yarı metaller ise metal ve ametal özelliklerini bir arada taşır. Örneğin, silisyum (Si).
- Özel Gruplar:
- Alkali Metaller (1. Grup): Çok aktif ve yumuşak metaller. Örneğin, sodyum (Na).
- Halojenler (17. Grup): Toksik ve oldukça reaktif ametaller. Örneğin, flor (F).
- Soygazlar (18. Grup): Tepkimeye girmeyen kararlı gazlar. Örneğin, helyum (He) ve neon (Ne).
Periyodik Çetvel Neden Önemlidir?
- Bilgiyi Organize Eder: Tüm elementler düzenli bir şekilde sıralandığı için, hangi elementin hangi özelliklere sahip olduğunu kolayca öğrenebiliriz.
- Tepkimeleri Tahmin Eder: Elementlerin hangi elementlerle nasıl tepkimeye gireceğini anlamak için ipuçları verir.
- Bilimsel Keşiflere Yol Açar: Periyodik çetvel, hala keşfedilmemiş elementlerin tahmin edilmesine yardımcı olmuştur.
Eğlenceli Gerçekler
- Hidrojen Her Şeyin Başlangıcıdır: Hidrojen, hem evrendeki en hafif element hem de periyodik çetvelin ilk elementidir.
- Altın ve Platin Soy Metaldir: Altın (Au) ve platin (Pt) gibi metaller, diğer elementlerle kolay kolay tepkimeye girmez. Bu yüzden mücevher yapımında kullanılır.
- Elementler Sonsuza Kadar Sabit Değildir: Süpernova patlamaları gibi büyük olaylarda yeni elementler oluşabilir.
Periyodik Çetvelin Tarihi
Periyodik çetvel, 1869 yılında Rus bilim insanı Dmitri Mendeleyev tarafından geliştirilmiştir. Mendeleyev, o dönemde bilinen elementleri düzenleyerek boşluklar bırakmış ve bu boşlukların daha sonra keşfedilecek elementler için olduğunu tahmin etmiştir. Tahminlerinin çoğu doğru çıkmıştır!
Periyodik Çetvel ile Çalışmaya Başlayın
Lise ve ortaokul öğrencileri için periyodik çetvel, kimya derslerinde vazgeçilmez bir araçtır. Çetvelin başında yer alan Hidrojen (H) ile başlayıp diğer elementlerin özelliklerini keşfetmek, kimyayı daha eğlenceli hale getirir. Ayrıca, çetveli renkli bir tasarımla çalışmak, bilgileri daha hızlı öğrenmenizi sağlayabilir.
Sonuç
Periyodik çetvel, kimyanın temel taşlarından biridir. Bilim insanlarının ve öğrencilerin kimyayı anlamasını kolaylaştıran bu harita, bilim dünyasında her zaman büyük bir öneme sahip olacaktır. Siz de bir sonraki kimya dersinizde periyodik çetveli inceleyerek elementlerin büyüleyici dünyasına adım atabilirsiniz!